Ketika Victor Ambrose dan Gary Ruvkun menemukan molekul baru yang mereka sebut microRNA pada tahun 1980an, hal ini merupakan perubahan yang menarik dari apa yang telah menjadi dogma utama biologi molekuler selama beberapa dekade.
Diakui dengan Hadiah Nobel Fisiologi atau Kedokteran tahun 2024, Ambrose dan Ruvkun mengidentifikasi jenis materi genetik baru yang mengubah cara peneliti memahami regulasi gen.
Seperti DNA, RNA adalah suatu bentuk materi genetik yang terbuat dari nukleotida tunggal yang dihubungkan dalam rantai. Menurut dogma utama, informasi genetik mengalir dalam satu arah: DNA ditranskripsi menjadi RNA, dan RNA diterjemahkan menjadi protein. Namun dalam satu penyimpangan besar dari dogma utama, beberapa RNA tidak pernah diterjemahkan atau dikodekan menjadi protein.
MicroRNA adalah salah satu jenis yang disebut RNA non-coding. Mereka adalah potongan pendek materi genetik yang, alih-alih mengkode protein tertentu, malah mengontrol RNA pengkode protein. Faktanya, microRNA menghidupkan dan mematikan gen tertentu.
Saya telah mengabdikan karir ilmiah saya untuk memahami cara kerja RNA, sebagian karena penelitian tentang RNA tertinggal dibandingkan makromolekul lain seperti DNA dan protein. Pengakuan molekul microRNA oleh Hadiah Nobel menandakan pentingnya molekul tersebut dalam biologi dan janjinya sebagai pengobatan potensial untuk berbagai penyakit, termasuk kanker.
MicroRNA memainkan peran penting dalam mengatur ekspresi gen. MicroRNA dan penyakit
Para ilmuwan menganggap mikroRNA sebagai pengatur utama genom karena kemampuannya mengikat dan mengubah ekspresi banyak RNA pengkode protein. Memang, satu mikroRNA dapat mengatur 10 hingga 100 RNA pengkode protein. Alih-alih menerjemahkan DNA menjadi protein, mereka malah dapat berikatan dengan RNA pengkode protein untuk membungkam gen.
Alasan mengapa mikroRNA dapat mengatur kumpulan RNA yang begitu beragam berasal dari kemampuannya untuk berikatan dengan RNA target yang tidak cocok dengannya. Ini berarti bahwa satu mikroRNA sering kali dapat mengatur serangkaian target yang semuanya terlibat dalam proses serupa di dalam sel, sehingga menghasilkan respons yang lebih kuat.
Karena satu mikroRNA dapat mengatur banyak gen, banyak mikroRNA yang dapat menyebabkan penyakit ketika mereka menjadi tidak berfungsi.
Pada tahun 2002, para peneliti pertama kali mengidentifikasi peran mikroRNA yang tidak berfungsi pada penyakit pada pasien dengan jenis kanker darah dan sumsum tulang yang disebut leukemia limfositik kronis. Kanker ini terjadi akibat hilangnya dua mikroRNA yang biasanya terlibat dalam menghalangi pertumbuhan sel tumor. Sejak itu, para ilmuwan telah mengidentifikasi lebih dari 2.000 mikroRNA pada manusia, banyak di antaranya berubah karena berbagai penyakit.
Bidang ini telah mengembangkan pemahaman yang cukup baik tentang bagaimana disfungsi microRNA berkontribusi terhadap penyakit. Perubahan pada satu mikroRNA dapat mengubah beberapa gen lainnya, sehingga menyebabkan banyak perubahan yang secara kolektif dapat membentuk kembali fisiologi sel. Misalnya, lebih dari separuh kanker telah secara signifikan mengurangi aktivitas mikroRNA yang disebut miR-34a. Karena miR-34a mengatur banyak gen yang terlibat dalam mencegah pertumbuhan dan migrasi sel kanker, hilangnya miR-34a dapat meningkatkan risiko terkena kanker.
Para peneliti ingin menggunakan microRNA sebagai terapi untuk kanker, penyakit jantung, penyakit neurodegeneratif, dan banyak lagi. Meskipun hasil di laboratorium menjanjikan, menghadirkan pengobatan microRNA ke klinik menghadapi beberapa tantangan. Banyak diantaranya terkait dengan pengiriman yang tidak efisien ke sel target dan stabilitas yang buruk, sehingga membatasi efektivitasnya.
MicroRNA dapat membungkam gen dengan mengikat mRNA. Kajsa Mollersen/Wikimedia Commons, CC BI-SA Pengiriman microRNA ke sel
Salah satu alasan mengapa pemberian pengobatan microRNA ke dalam sel sulit dilakukan adalah karena pengobatan microRNA perlu diberikan secara khusus ke sel yang sakit, menghindari sel yang sehat. Berbeda dengan mRNA pada vaksin COVID-19, yang diserap oleh sel-sel kekebalan yang bertugas mendeteksi benda asing, perawatan microRNA perlu mengelabui tubuh agar mengira bahwa benda tersebut bukan benda asing untuk menghindari serangan kekebalan dan mencapai sel yang dituju.
Para ilmuwan sedang mempelajari berbagai cara untuk memberikan perawatan microRNA ke sel target spesifik mereka. Salah satu metode yang mendapat banyak perhatian bergantung pada menghubungkan langsung mikroRNA ke ligan, sejenis molekul kecil yang mengikat protein spesifik pada permukaan sel. Dibandingkan dengan sel sehat, sel yang sakit mungkin memiliki jumlah protein permukaan atau reseptor yang tidak proporsional. Dengan demikian, ligan dapat membantu mikroRNA untuk secara spesifik menargetkan sel yang sakit sekaligus menghindari sel sehat. Ligan pertama yang disetujui oleh Badan Pengawas Obat dan Makanan AS untuk mengirimkan RNA kecil seperti microRNA, N-acetylgalactosamine atau GalNAc, terutama mengirimkan RNA ke sel hati.
Mengidentifikasi ligan yang dapat mengantarkan RNA kecil ke sel lain memerlukan penemuan reseptor yang diekspresikan pada tingkat yang cukup tinggi pada permukaan sel target. Biasanya, diperlukan lebih dari satu juta salinan per sel untuk mencapai penghantaran obat yang memadai.
Salah satu ligan yang menonjol adalah folat, juga disebut vitamin B9, sebuah molekul kecil yang sangat penting selama periode pertumbuhan sel yang cepat seperti perkembangan janin. Karena beberapa sel tumor memiliki lebih dari satu juta reseptor folat, ligan ini memberikan peluang luas untuk memberikan RNA terapeutik yang cukup untuk menargetkan berbagai jenis kanker. Misalnya, laboratorium saya mengembangkan molekul baru yang disebut FolamiR-34a—folat terkait miR-34a—yang mengurangi ukuran tumor kanker payudara dan paru-paru pada tikus.
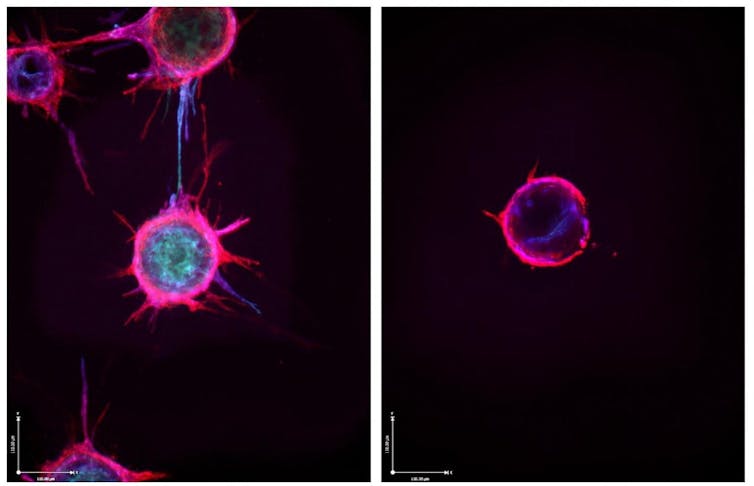
Tumor dapat menggunakan sel-sel sehat untuk menumbuhkan pembuluh darah yang memasok nutrisi, seperti yang terlihat pada sel-sel endotel di sisi kiri perluasan yang sedang tumbuh. Namun, memaparkan sel-sel ini pada microRNA tertentu dapat menghambat pertumbuhan tersebut, seperti yang terlihat pada sel di sebelah kanan. Lab Dudley, Fakultas Kedokteran Universitas Virginia/NIH melalui Flickr, CC BI-NC Membuat microRNA lebih stabil
Salah satu tantangan lain dalam penggunaan RNA kecil adalah stabilitasnya yang buruk, yang menyebabkan degradasinya cepat. Oleh karena itu, pengobatan berbasis RNA umumnya berumur pendek di dalam tubuh dan memerlukan dosis yang sering untuk mempertahankan efek terapeutik.
Untuk mengatasi tantangan ini, para peneliti memodifikasi RNA kecil dengan berbagai cara. Meskipun setiap RNA memerlukan pola modifikasi tertentu, perubahan yang berhasil dapat meningkatkan stabilitasnya secara signifikan. Hal ini mengurangi kebutuhan pemberian dosis yang sering dan selanjutnya mengurangi beban dan biaya pengobatan.
Misalnya, GalNAc-siRNA yang dimodifikasi, bentuk lain dari RNA kecil, mengurangi dosis dari setiap beberapa hari menjadi setiap enam bulan pada sel yang tidak membelah. Tim saya mengembangkan ligan folat yang dihubungkan dengan mikroRNA yang dimodifikasi untuk pengobatan kanker yang mengurangi dosis dari dua hari sekali menjadi seminggu sekali. Untuk penyakit seperti kanker di mana sel-sel membelah dengan cepat dan dengan cepat mengencerkan mikroRNA yang dikirimkan, peningkatan aktivitas ini merupakan kemajuan yang signifikan di bidang ini. Kami berharap pencapaian ini akan memfasilitasi pengembangan lebih lanjut mikroRNA terkait folat sebagai obat kanker di tahun-tahun mendatang.
Banyak laboratorium yang berupaya mengembangkan pengobatan berdasarkan penemuan peraih Nobel baru Ambrose dan Ruvkun beberapa dekade lalu. Meskipun masih banyak pekerjaan yang harus dilakukan untuk mengatasi rintangan yang terkait dengan pengobatan microRNA, jelas bahwa RNA menjanjikan sebagai terapi untuk banyak penyakit.
Ini adalah versi terbaru dari artikel yang pertama kali diterbitkan pada 29 November 2023.




